Wir haben eine mutualistische aber komplizierte Beziehung mit der Sammlung von Mikroben in unserem Darm bekannt als der Darm-mikrobiom. Diese komplexe Gemeinschaft von Bakterien zersetzt verschiedenen Lebensmittel-Komponenten, und gibt Nährstoffe, wie Vitamine und eine fülle von anderen Faktoren, die die Steuerung der Funktionen in Geweben, die weit über dem Darm-Trakt. Aber die schiere Zahl der Mikroben auch eine Bedrohung, wie Sie ausgelöst werden kann die Entzündung, die gedacht wird, um an der Wurzel der vielen Darm-Erkrankungen, einschließlich chronisch entzündlichen Darmerkrankungen, Strahlen-induzierte intestinale Verletzungen, und einige Krebsarten.
Ermöglichen die Aufnahme von wichtigen Substanzen aus dem darmlumen, und gleichzeitig verhindern, dass Darm Mikroben Kontakt mit der intestinalen epithelialen Gewebe Oberfläche, spezialisierte Zellen, die sogenannten Becher-Zellen kontinuierlich produzieren Schleim, der schleimigen goo-ähnliche Substanz, die Mäntel der gesamte Darm-Oberfläche. Schleim war bisher notorisch schwierig zu studieren: seine Struktur schnell zerfällt in die chirurgisch entfernt Abschnitte des Darms, die das system am häufigsten verwendet, um zu studieren Schleim, und keine in-vitro-Kultur-system in der Lage war, zu rekonstruieren-eine in-vivo-ähnlichen Schleim-Schicht, die mit der natürlichen Struktur gesehen, in Wohn-Darm außerhalb des menschlichen Körpers. Hinzufügen, um diese Schwierigkeiten, Schleim unterscheidet sich auch zwischen Menschen und anderen Spezies, verschiedene Abschnitte des Magen-Darm-Trakt, und sogar der verschiedenen Individuen.
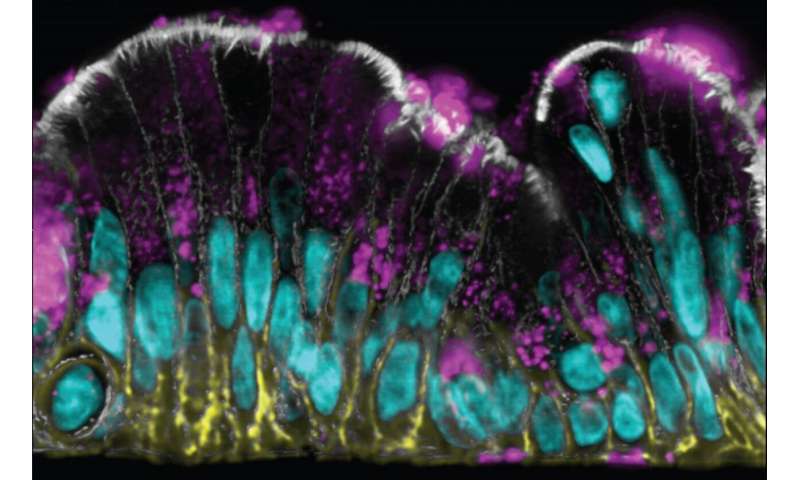
Jetzt, mit Schwerpunkt auf der Dickdarm beherbergt die größte Anzahl von Kommensalen Mikroben und hat den dicksten Schleim-Schicht, ein team von tissue-Ingenieure an der Harvard Wyss Institut für Biologisch Inspirierte Engineering entwickelt hat, eine colon-on-a-chip (Colon-Chip) mikrofluidischen Kultur Gerät gesäumt von Patienten-abgeleiteten Doppelpunkt Zellen, die spontan sammelt eine Schleim-Schicht mit der Dicke, bi-Schichten-Struktur und Barriere-Funktionen in der Regel gefunden in normal human colon. Die Schleimhaut-Oberfläche in Ihrem Modell entspricht Sie auch der entzündungsmediator prostaglandin E2 (PGE2) durch die Montage einer raschen Schwellung Antwort. Ihre Ergebnisse veröffentlichen Sie in Zelluläre und Molekulare Gastroenterologie und Hepatologie.
„Unser Ansatz bietet den Forschern die Gelegenheit, Antworten zu finden auf Fragen, die über den normalen und krankheitsbedingten Schleim, der Biologie, der wie seine Beiträge zur intestinalen entzündlichen Krankheiten und Krebserkrankungen und komplexe Wirt-mikrobiom-Interaktion“, sagte Gründungsdirektor Donald Ingber, M. D., Ph. D., der senior investigator der Studie. „Wichtig ist, dass wir verwenden, Patienten-abgeleiteten Zellen, um diese Geräte und so stellt dies einen völlig neuen Ansatz für personalisierte Medizin, wo es möglich sein kann, zu untersuchen, wie Schleim Funktionen oder Funktionsstörungen in einem bestimmten Patienten, und um die Therapie entsprechend anzupassen.“
Ingber ist auch der Judah Folkman Professor für Vaskuläre Biologie an der Harvard Medical School und der Vaskulären Biologie-Programm an der Boston Kinderkrankenhaus, sowie Professor für Bioengineering an der Harvard ‚ s John A. Paulson School of Engineering und Applied Sciences. Sein team ist Teil einer multi-institutionellen Zusammenarbeit, unterstützt durch ein Cancer Research UK ‚ s Grand Challenge grant, in dem seine Wyss team untersucht, wie die Entzündung-bedingten Veränderungen tragen zur Entstehung von Krebs, einschließlich Darmkrebs. Die Grand Challenge ist ein ehrgeiziges, international cancer research initiative, die Unterstützung der weltweit führenden Forschergruppen auf einige der schwierigsten Herausforderungen bei Krebs, und es gibt Ihnen die Freiheit, um zu versuchen, neue Ansätze im großen Maßstab.
Der team-Ansatz beginnt mit der Patienten-abgeleiteten Doppelpunkt Zellen aus Dickdarm-Resektion und endoskopische Biopsien, die ersten gewachsen „organoids“, winzige Bälle organisiert von Kolon-Gewebe, enthalten hauptsächlich epithelialen Stammzellen. Nach der Zerstückelung des organoids, Ihre Zellen verwendet, zum Auffüllen der oberen von zwei parallelen Kanälen eines Mikrofluidik-chip, getrennt durch eine poröse Membran. Einfach durch perfusing die Kanäle kontinuierlich mit Nährlösung, die Dickdarm-Stammzellen wachsen in einem kontinuierlichen Blatt und form sehr funktionelle goblet-Zellen, sezernieren Schleim.
„Wachsen die Zellen auf dem chip unter flow-Ergebnisse in ungefähr 15% der epithelialen Zellen spontan differenzieren, in Goblet-Zellen. Verteilt in der gesamten Epithel, und diese erzeugen eine in-vivo-ähnlichen Schleim-Schicht,“ sagte ersten Autor Alexandra Sontheimer-Phelps, ein student der Universität Freiburg, Deutschland, arbeiten in Ingber Gruppe. „Zur gleichen Zeit, anderen epithelialen Zellen, halten die Teilung auch wieder Auffüllen, den Becher Zellpopulation wie im Leben, Doppelpunkt, was bedeutet, dass der chip aufrechterhalten werden kann, in der steady-state-Bedingungen für mehr als zwei Wochen, das macht es sehr nützlich für längerfristige Studien.“
Das Wyss-team zeigte, dass die colon-Epithel in dem chip ist vollständig polarisiert, mit deutlichen Markierungen eingeschränkt ist, um seine lumen-exponierten, Schleim-sezernierenden Seite und die gegenüberliegende Membran-bindende Seite. Seine goblet-Zellen sezernieren die wichtigsten Schleim protein mucin 2 (MUC2), die bei der Verknüpfung zu komplexen Ketten von Zuckermolekülen, montiert in die multi-molekulare Netzwerk oder gel, das Wasser aufnimmt. „Unser Ansatz tatsächlich produziert die bi-Schichten-Struktur des normalen Dickdarm Schleim von innen mit einer dichten Schicht, die wir zeigen, ist undurchdringlich für Bakterien-ähnlichen Partikeln durchströmt den Darm-Kanal, und einen lockeren äußeren Schicht, die erlaubt, dass Partikel zu geben. Dieser wurde nie vollendet, bevor die in-vitro“, sagte Sontheimer-Phelps.
Zur Untersuchung der Funktionalität der Schleimhäute, die Sie und Ihre co-Arbeitnehmer, die exponiert werden, den chip auf dem entzündungsmediator PGE2. Der Schleim unterzog schnelle Schwellung innerhalb von Minuten und unabhängig von jeder neuen Schleim-Sekretion, und dieser Prozess der Schleim Akkumulation visualisiert werden können, die in lebenden Kulturen, indem Sie die chips von der Seite mit Dunkelfeld-Beleuchtung. Diese Dynamik könnte blockiert werden, die durch Hemmung eines bestimmten ionenkanals, die Pumpen, die Ionen in den Darm Epithel und passiv Wasser-Moleküle zu Folgen, und offenbar treibt Schleim Schwellung beim, angeregt durch Signale wie PGE2.