Eine angeborene Herzerkrankung, bekannt als linksventrikuläre non-compaction (LVNC), die Auftritt, wenn muscly Projektionen im embryonalen Herzen nicht zu transformieren, die in kompakte Herzmuskels, kann verursacht werden, durch die Signalisierung Mängel, nach neuen präklinischen Forschung, geführt von der Duke-NUS Medical School in Singapur. Die Feststellung, veröffentlicht in der Zeitschrift JCI Einblick, könnte ebnen den Weg zu einer möglichen Diagnose und Therapien.
Während der normalen embryonalen Herzen-Entwicklung, Muskel-Zellen Wandern und sich vermehren, bilden fingerförmige Ausstülpungen im inneren des Herz-Kammer. Die Projektionen, die sogenannten trabekel, helfen mit Herz Ernährung und Oxygenierung bis Blutgefäße bilden. Sie sich schließlich auflösen, was zur Bildung einer kompakten, glatten und Feste Herz-Wand. In einigen Embryonen, aber die trabekel scheitern auflösen und bilden Feste Herz-Wand, die zu LVNC, in denen die trabekel Projekt in eine verdünnte untere linke herzkammer.
„LVNC ist eine der häufigsten Erkrankungen im Herz-Kammer-Reifung. Menschen geboren, die mit dieser Erkrankung Häufig keine Symptome, können aber ein höheres Risiko von Herzinsuffizienz, Herzrhythmusstörungen oder plötzlichem Herztod“, sagte Assistant Professor Manvendra Singh von der Duke-NUS “ Herz-Kreislauf-und Stoffwechselerkrankungen (CVMD) Programm, die älteren und entsprechenden Autor der Studie.
Weltweit, so die Wissenschaftler, das Verständnis der molekularen und genetischen Veränderungen, die an LVNC ist begrenzt. Asst Prof Singh und seine Kollegen in Singapur, Japan und den USA wollte, um zu testen, ob ein bestimmtes protein, Sema3E, verbunden ist, um die Mängel gesehen in LVNC. Sema3E ist bekannt, zum verbinden mit einem Zell-rezeptor, genannt PlexinD1, welche sich in der embryonalen Herz die Entwicklung. Jedoch, Sema3E Existenz in das Herz hatte noch nicht bestimmt worden.
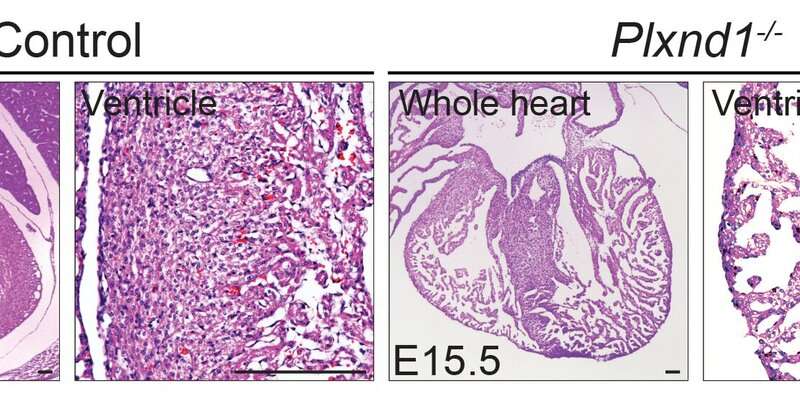
Die Mannschaft, die zuerst ausgeschaltet Plxnd1, die Gens, dass codes für die PlexinD1-rezeptor, in einem präklinischen Modell von embryo-Herzen. Dies führte zu einer übermäßigen Bildung von knochenbälkchen, die nicht an sich verdichtet, das geschieht normalerweise in der gesunden Herz-Wände.
Molekulare Analysen zeigten, dass das ausschalten Plxnd1 führte zu einer erhöhten Aktivität von anderen Genen ausgelöst durch einen „Notch signaling pathway.“ Die Hemmung dieses Besondere Weg teilweise verhindert das Herz von der Entwicklung von Fehlbildungen. Das team hat auch bestätigt, dass viele verschiedene Arten von Zellen in den sich entwickelnden Herzen ausgedrückt Sema3E. Ausschalten des Gens, dass codes für Sema3E deutlich reduziert Herz Wandstärke.
„Unsere Studie hat uns geholfen, besser zu verstehen, die Rolle der Semaphorin-Plexin-Signal in diesem bestimmten angeborenen Herzerkrankung,“ sagte Frau Reddemma Sandireddy, der Studie führen Autor, der ein wissenschaftlicher Mitarbeiter in der CVMD Programm. „Die Ergebnisse zeigen, dass Sema3E verbindet mit seiner PlexinD1 rezeptor ausschalten des Notch-Signalwegs, was darauf hinweist, dass seine Rolle bei der Bildung und Reifung der unteren Herzkammern.“
Professor Patrick Casey, Senior Vize-Dekan für Forschung an der Duke-NUS Medical School, sagte, „Derzeit ist jeder Dritte Todesfall in Singapur ist aufgrund von Herz-Kreislauf-Erkrankungen. Kardiomyopathie (herzmuskelerkrankung) ist eine der schwersten Herz-Kreislauf-Erkrankungen, und diese Forschung erweitert unsere Kenntnis von einer besonderen form der Kardiomyopathie und potenzielle neue Ziele, um den Zustand zu behandeln.“