Biomedizinische Ingenieure an der Duke University haben eine Methode entwickelt, um Adresse Ausfälle in eine vielversprechende anti-Krebs-Medikament, die Zusammenführung tools von Genom-engineering, protein-engineering und Biomaterialien Wissenschaft zur Verbesserung der Wirksamkeit, Genauigkeit und Langlebigkeit von bestimmten Krebs-Therapien.
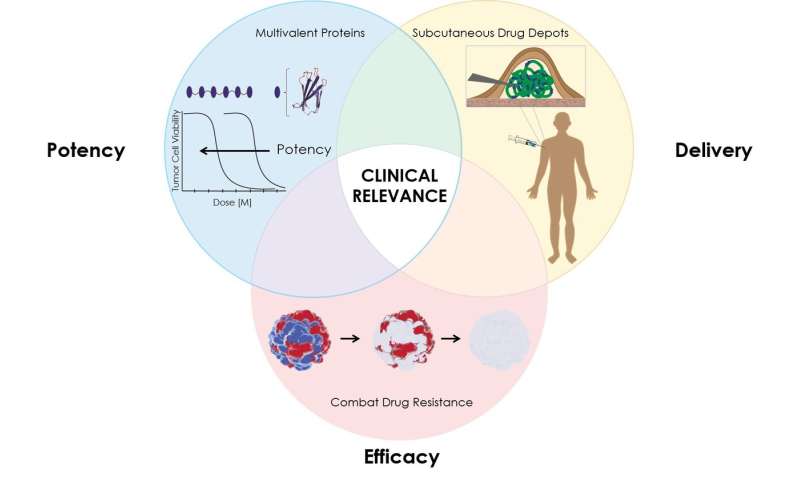
Mit einer Kombination von CRISPR-basierte targeting-ein protein, das „depot“, die ermöglicht, dass die verzögerte Freisetzung des Medikaments und einer hochwirksamen Bindungs-system, zeigte das team, dass Ihre neue Strategie überwinden konnten drei kritische Probleme, die Grenze der Wirksamkeit vieler Krebsmedikamente, die— Ihrer begrenzten Potenz, schnelle elimination aus dem Körper, und die Fähigkeit der Krebszellen entwickeln Resistenzen gegen das Medikament.
Die Forschung, online erschienen Sept. 4 in der Zeitschrift Wissenschaft Fortschritte.
Vor mehr als 20 Jahren, entdeckten die Forscher, dass das protein Droge WEG, die Abkürzung für TNF-related apoptosis-inducing ligand, könnte effektiv zu töten Krebszellen, ohne dabei gesunde Zellen—zumindest im Labor. WEG funktioniert durch die Bindung an spezifischen protein-Rezeptoren auf Krebszellen, seltsamerweise namens death-Rezeptoren, die ein signal zu senden, das bewirkt, dass die Zellen sich selbst zu zerstören. Obwohl die ersten versuche zeigten, dass die Droge arbeitete in einer Vielzahl von krebszelllinien, einschließlich Melanom, Lymphom, Pankreas -, Prostata -, Lungen -, Darm-und Brustkrebs, TRAIL und ähnliche Medikamente überraschte die Forscher, indem Sie zeigen nur begrenzten Erfolg in klinischen Studien.
Nachdem weitere Studie, die Wissenschaftler suchten drei Gründe, warum das viel versprechende Medikament ist fehlgeschlagen: TRAIL war nicht stark genug, das Medikament wurde von uns gereinigt und aus dem Körper zu schnell und einige Krebs-Zellen waren resistent gegen die Therapie.
Mit einer Kombination der drei Werkzeuge—ein hochwirksames protein-Droge, ein „depot“, die ermöglicht, dass die verzögerte Freisetzung des Medikaments, und CRISPR/Cas9 basiert gen Bearbeiten der Ermittlung der Ursache von Widerstand gegen die Droge—das Duke-team, die Mandana Manzari, einer aktuellen Ph. D.-Absolvent, Ashutosh Chilkoti, der Stuhl Herzog, biomedizinische Technik, und Kris Holz, ein Assistenzprofessor von Pharmakologie und von Krebs-Biologie, bewiesen, dass Ihre neue Strategie könnte eine Lösung für diese Probleme und protein-basierte anti-Krebs „biologics“ wie WEG, konnte nicht in der Klinik eine zweite chance.
„Die wirkliche Bedeutung dieser Forschung für mich ist das wahre Kreuz-disziplinäre Natur“, sagte Manzari, ersten Autor auf dem Papier und nun noch ein post-doc-Forscher am Memorial Sloan Kettering Cancer Center in New York. „Das ist wirklich das erste Beispiel, das ich gesehen habe, wo bringen wir in der Pharmakologie, drug delivery und genomics zur Ermittlung der genauen Umstände, die zu einer biologischen zu scheitern und dann Lösungen zu entwickeln.“
Der erste Schritt des Prozesses beteiligt Adressierung TRAIL eingeschränkten Potenz. Normalerweise haben die Zellen mehrere Todes-Rezeptoren, sondern einen spezifischen rezeptor namens death receptor 5 (DR5) ist häufiger in bestimmten Krebszellen. TRAIL, ein drei-part-protein, bindet an den DR5 und links drei Todes-Rezeptoren zusammen, ein signal für die Zellen selbst zu zerstören. TRAIL kann auch zu binden, um andere todesrezeptoren und „decoy“ – Rezeptoren, die auf normalen Zellen. Ein potenter Wirkstoff wäre speziell für einen bestimmten todesrezeptor DR5 wie auf Krebs-Zellen, und link zusammen eine größere Anzahl des Rezeptors auf der Zelloberfläche zu senden, eine stärkere Tod-signal für die Krebs-Zelle.
Manzari produziert ein hochwirksames, sechs-Teil death-rezeptor-Agonisten (DRA), die binden konnte sechs todesrezeptoren zusammen und indude eine viel stärkere self-destruct-signal.
Als Nächstes das team untersuchte, wie um zu verhindern, dass der super-potente Tod-rezeptor-Agonisten von uns gereinigt und aus dem Körper zu schnell. Sie genetisch fusioniert der DRA zu einem Temperatur-responsive protein namens elastin-ähnliches Polypeptid (ELP), Formen, die eine gel-like „depot“ in einem Raumtemperatur-Lösung. Nachdem die Lösung unter die Haut injiziert wird, löst es sich auf, die Freigabe der DRA über einen längeren Zeitraum.
Schließlich Chilkoti und Manzari gemeinsam mit Kris Holz, um besser zu verstehen, was verursacht hat, dass bestimmte Zellen, um dem Tod zu widerstehen, die durch TRAIL oder Tod-rezeptor-Agonisten (DRA). Das team systematisch Behinderte verschiedener Gene in den Krebszellen unter Verwendung CRISPR/Cas9 bis konnten Sie ableiten, welche verantwortlich waren für TRAIL-oder DRA-Widerstand. Dann wählte Sie Drogen, um das Ziel Proteine durch diese Gene und gepaart mit der DRA-slow-release-depot.
„Diese Arbeit eröffnet eine weitere spannende Möglichkeit für targeting eine kritische cell death pathway in cancer, ein Gebiet von wachsendem Interesse in der translationalen Krebs-Therapeutika Gemeinschaft“, erzählt Wood.
„Wenn wir herausgefunden das Gene, Laufwerk, Widerstand, wir waren in der Lage, ordnen Sie Sie im Handel erhältliche Medikamente könnten gezielt die Proteine, die von Genen“, sagte Manzari. „Es ist im Grunde gab uns die Plattform, um herauszufinden, welche Medikamente kombinieren wir mit dem DRA in Fällen, in denen das Medikament oder andere protein-Drogen nicht gut für nip, dass der Widerstand im Keim.“
Mit Ihren triple-whammy-tool, das team war in der Lage, effektiv zu überwinden intrinsische Resistenz, hemmen das Tumorwachstum und das überleben zu verlängern, in Mäuse, die implantiert wurden, die mit Darmkrebs, die von menschlichen Patienten, die sehr resistent auf die Behandlung mit TRAIL.
Nun, die Wissenschaftler denken, wie könnten Sie diese Methode, um andere protein-und klein-Molekül Drogen, die vor ähnlichen Hindernissen, die in Ihrer Wirksamkeit eingeschränkt werden.
„Ich denke, die Sache, die wirklich setzt dieser Ansatz unterscheidet, ist die Gestaltung jedes Stück die Plattform Rational um ein spezifisches problem anzusprechen und zusammenzuführen, ganzheitlich zu lösen, drei kritische Probleme, die das limit nicht einfach WEG, aber viele neue Krebs-Therapien,“ sagte Chilkoti.