Die Mechanismen von Muskel-Funktion sind nicht vollständig verstanden werden, auf der molekularen Ebene. Magnus Andersson und seine Forschungsgruppe haben gezeigt, wie ein protein, das regulieren Muskel-Entspannung erfährt strukturelle änderung in der kritischen phase pumpt Kalzium aus den Muskelzellen wieder zu seiner Lagerung.
Die Studie, veröffentlicht heute in der Zeitschrift Wissenschaft Fortschritte, neue Wege beschreitet, nicht nur in der biologischen Perspektive, aber auch im Hinblick auf die technischen Fortschritte.
Zum durchführen von Reaktionen lebensnotwendig, Proteine müssen zu ändern Sie Ihre 3-D-Strukturen. Diese inhärente Flexibilität kodiert wurde, in die Aminosäuresequenz des proteins während der evolution. Zum Verständnis der Proteinfunktion auf molekularer Ebene, ist es notwendig, um anzeigen, wie die protein-Komponenten zu bewegen, das ist, wie das protein übergang zwischen den verschiedenen Zwischenstufen.
Einige dieser Zwischenstufen stabilisiert werden können, die es ermöglicht, strukturelle Bestimmung, aber die meisten Staaten sind leider nicht stabil genug für solche Experimente. Von „Filmen“ aus der Reaktion mit fast X-ray pulses direkt in der natürlichen Umgebung ist es möglich zu verfolgen, die Entwicklung von Zwischenstufen, ohne die Notwendigkeit für künstliche Stabilisierung Methoden, wie Kristallisation.
Da die strukturellen Veränderungen sind subtil, die Experimente werden an synchrotrons können Einzahlung 1010 Photonen auf die Probe, während ein 100-picosekunden-pulse. Dieser neuen Methode bisher beschränkt, um lichtempfindliche Proteine, da die Eiweiß-Reaktion, ausgelöst durch einen Laserpuls.
In der neuen Studie, Magnus Andersson und seine Mannschaft hat stattdessen initiiert die Reaktion durch laser-induzierte Freisetzung von ATP aus einem lichtempfindlichen inaktive form von ATP.
„Eine große Zahl von lichtempfindlichen Substanzen, z.B. Neurotransmitter und Metaboliten im Prinzip ermöglichen, ähnliche Experimente für eine ganze Reihe von wichtigen protein-Ziele“, sagt Magnus Andersson, Associate professor an der Abteilung von Chemie an der Universität von Umeå.
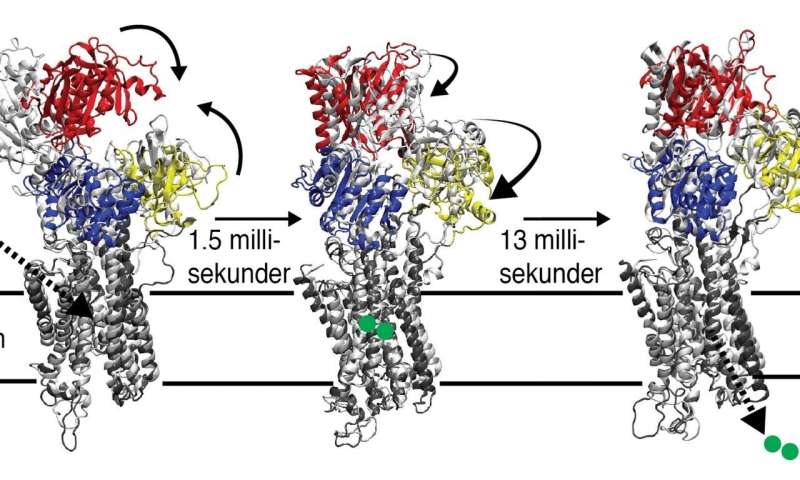
Das spezifische protein, untersucht in dieser Studie reguliert die Entspannung der Muskeln und ist daher von Bedeutung, z.B. für die normale Herz-Funktionalität. Zu ermöglichen, für die Muskeln zu entspannen, den calcium während der Kontraktion muss zurück transportiert werden, um dem sarkoplasmatischen Retikulum, SR, welches ein röhrenförmiges system, das die Muskelzelle.
Calcium nicht passieren können, über die SR-Membran von selbst, sondern braucht aktive Pumpen durch den SERCA-protein. Der Pump-Prozess fordert die Energie-und die SERCA-protein wird nicht starten, ohne Zugang zu dem Energieträger ATP. Trotz einigen bekannten intermediären Strukturen, gefangen durch die Verwendung von ATP-Analoga, strukturelle Informationen aus den kritischen übergang, wenn das protein transportiert das Kalzium zurück zu den SR-Speicher zu ermöglichen, den Muskel zu entspannen, ist noch immer in weiter Ferne.
In einer Reihe von Experimenten am ESRF synchrotron in Grenoble, Frankreich, haben die Forscher erhoben, time-resolved X-ray-Daten direkt in die biologische SR-Membranen, in denen der Proteingehalt zu 90 Prozent aus der SERCA-Proteine.
„Weil die Messungen auf eine Lösung, die besteht aus vielen kreisförmigen Membran-Fraktionen, die sich frei bewegen im Verhältnis zu jedem anderen, die gewonnenen strukturellen Informationen werden mit niedriger Auflösung und ohne details. Heute ist der Pfad führt zu einer detaillierten molekularen Blick auf die gefilmte Reaktion ist weit von standardisiert.“
In der Studie, die Forscher nützten die Kapazität im heutigen Supercomputern und algorithmen, gelang es, zu identifizieren, die zwei Strukturen von SERCA Zwischenstufen. In der ersten beobachteten Zustand bei 1,5 Millisekunden, das protein geschlossen hatte, um das Molekül ATP und Kalzium aus den Muskelzellen. Dann, bei 15 Millisekunden, ein Staat mit einer bisher unbekannten Struktur wurde beobachtet, dass stellt das protein in dem moment, bevor die Freigabe calcium zurück, um seine SR-Speicher-Fach.
Die Beobachtung von neuen protein-Strukturen hilft, das Verständnis der zugrunde liegenden molekularen Mechanismen für die Muskel-Funktion, die entscheidend für das Verständnis z.B. von Herz-Krankheit.
„Time-resolved X-ray scattering Experimente ermöglicht nicht nur die strukturelle Bestimmung der instabilen Zwischenprodukte, sondern auch liefern diese Strukturen mit einem Zeitstempel. Auf diese Weise wird es möglich, zu bestimmen, wie verschiedene Zwischenstufen im Laufe der Zeit entwickeln und zu untersuchen, wie diese Reaktion Kinetik unterscheiden sich mit Umwelt-cues, wie pH-Wert, Temperatur und der chemischen Zusammensetzung, oder unter Bedingungen, die Kennzeichnen, z.B. mutation-induzierten Krankheiten“, sagt Magnus Andersson.